Mijnheer Poels, vorige week sloten we af met de administratieve druk die de IVDR met zich meebrengt voor bedrijven. Meer administratie betekent ook hogere kosten voor die bedrijven. Merken jullie dat met het FAGG?
De overgang naar de nieuwe wetgeving is inderdaad niet te onderschatten voor IVD-bedrijven. Voor "medical device"- of MD-bedrijven is de regelgeving ook veranderd met de komst van de Medical Device Regulation (MDR), maar de wijzigingen zijn minder ingrijpend dan die onder de IVDR.
'IVD-bedrijven zijn vaak kmo's en beschikken niet over enorme middelen.'
Bovendien zijn heel wat IVD-bedrijven kmo's die niet over dezelfde middelen beschikken als de vaak grote MD-fabrikanten. Europa probeert daar rekening mee te houden, bijvoorbeeld met de SME Relief Package (2023) en met een EU-strategie specifiek voor start-ups en scale-ups (2025).
Door de IVDR later in werking te laten treden en door in extra overgangsperiodes te voorzien, wil Europa alle betrokken stakeholders voldoende tijd geven om zich in orde te stellen.
De druk op IVD-bedrijven blijft evenwel een feit. De scherpere eisen rond klinisch bewijs en de controles door notified bodies en eventueel ook Europese referentielaboratoria verhogen de kosten voor bedrijven onvermijdelijk. We horen dan ook dat IVD-fabrikanten hun productportfolio kritisch herevalueren - welke producten willen ze "meenemen" naar het IVDR-kader en welke zetten ze stop?
De zwaardere IVDR maakt innoveren onvermijdelijk nog duurder dan het al was. Vrezen jullie dat de IVDR een rem kan zetten op vernieuwing?
Dat valt vandaag moeilijk te voorspellen, maar ik hoop alvast van niet. Europa wil het in elk geval niet zover laten komen en heeft een werkgroep opgericht om de procedures voor "breakthrough innovation" te versnellen.
Het FAGG trekt, als sterk gewaardeerde autoriteit binnen de EU, volop mee aan die kar.
Het FAGG is inderdaad een sterk internationaal merk in Europa. Dat blijkt ook duidelijk uit de zeer actieve rol die jullie spelen in onder andere de Medical Device Coordination Group (MDCG).
Onze administratie is inderdaad zeer actief, en dat in alle 13 werkgroepen van de MDCG. Die werkgroepen behandelen alle aspecten die relevant zijn voor de implementatie van de IVDR en de MDR, zoals aanmelding en controle van aangemelde instanties, vigilantie, marktcontrole, klinische en performantiestudies, etc.
'Bevoegde instanties van andere lidstaten doen geregeld een beroep op de Belgische expertise rond IVD's.'
Eén werkgroep focust specifiek op de homogene interpretatie en implementatie met betrekking tot IVD's en verleent de andere 12 groepen advies over IVD-specifieke topics. Sinds 2022 heeft de IVD-werkgroep liefst 16 guidance documenten gepubliceerd. Met het FAGG hebben we aan elk van die 16 documenten meegewerkt, vaak in een leidende rol. De bevoegde instanties van andere EU-lidstaten erkennen die expertise en vragen geregeld onze opinie over IVD-topics.
Zelf ben ik trouwens recent covoorzitter geworden van de taskforce voor orphan IVD's - een orphan IVD is een test voor een zeer kleine groep patiënten. Met die taskforce onderzoeken we hoe we wees-IVD's makkelijker en sneller beschikbaar kunnen maken in Europa.
We hebben het al uitgebreid gehad over de extra druk die de IVDR met zich meebrengt voor bedrijven. Hoe zit het met de druk op jullie administratie?
De EUDAMED-databank moet op termijn een deel van de administratieve last voor ons helpen opvangen, maar dat is vandaag nog niet het geval. Intussen zijn er heel wat taken uitgebreid en hebben we nieuwe taken gekregen. Dus ja, de IVDR brengt dus ook voor ons extra druk met zich mee, zeker op korte termijn.
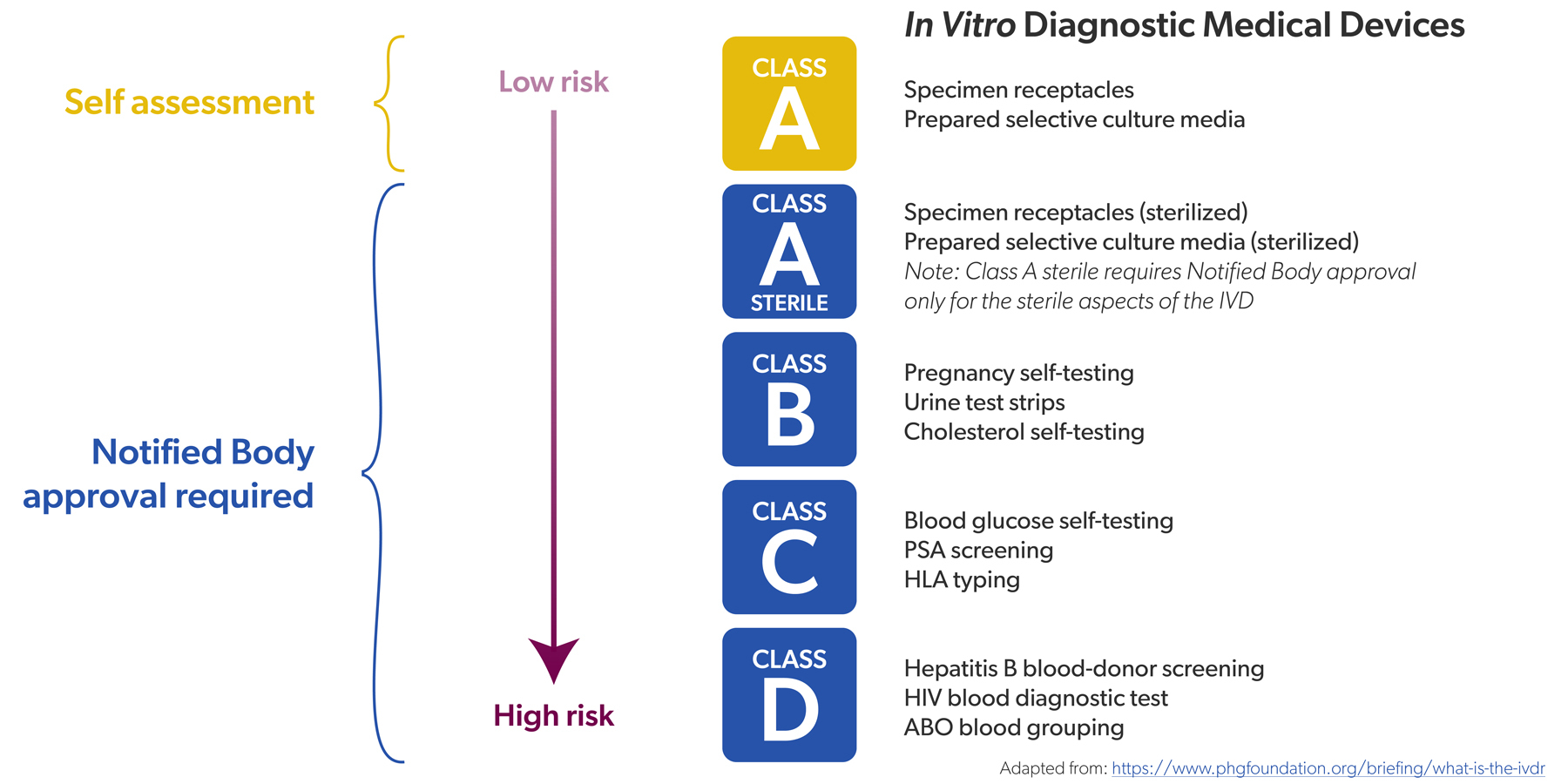
Tezelfdertijd zijn er belangrijke positieve signalen. Lang was er de terechte vrees dat de capaciteit aan aangemelde instanties niet zou volstaan voor de IVDR - het aantal IVD's dat een conformiteitsbeoordeling moet ondergaan, is toegenomen van 20 naar 80% (zie ook deel 1 van het interview). Maar dat probleem lijkt zich op te lossen.
Van de 17 notified bodies voor de IVDR zijn er momenteel slechts 2 die geen nieuwe klanten meer aannemen, zo blijkt uit een recente enquête. Eén van de nieuwste NB's op de lijst is trouwens SGS Belgium; daarmee heeft ook ons land nu een aangemelde instantie voor de IVDR, wat uiteraard goed nieuws is voor fabrikanten in België!

Verder zien we het aantal aanvragen voor prestatiestudies toenemen. Vaak gaat het om combinatiestudies met een geneesmiddel. De IVD-test dient dan om patiënten voor de trial te selecteren en wordt later eventueel als companion diagnostic gecommercialiseerd. Er loopt momenteel een groot Europees project, COMBINE, om de aanvragen van combinatiestudies te vereenvoudigen en harmoniseren.
Die signalen zijn erg belangrijk. De IVDR moet tenslotte een positief verhaal worden.
Absoluut, in de eerste plaats voor individuele patiënten en de volksgezondheid.
De potentiële voordelen van de IVDR voor patiënten zijn overduidelijk: hoe performanter en veiliger medische hulpmiddelen voor in-vitro diagnostiek, hoe beter voor de patiënt. En dankzij de betere traceerbaarheid kunnen hulpmiddelen zeer gericht opgespoord worden als er toch iets fout mee zou lopen.
'Hoe performanter en veiliger IVD's zijn, hoe beter voor de patiënt.'
Alle maatregelen binnen de IVDR dragen daar in meer of mindere mate aan bij. Het is onvermijdelijk dat bij een dergelijke grote wijziging aan de regelgeving er ook heel wat aandachtspunten zijn. Maar die mogen op zich geen reden vormen om de hele hervorming in vraag te stellen.
Het is zaak om de IVDR continu en nauwgezet te evalueren en te durven bijsturen waar nodig: wat kan eenvoudiger, welke vereisten bieden te weinig meerwaarde en kunnen we dus bijstellen of afschaffen, etc. Europa gaat actief op zoek naar die feedback - zo is eind maart een publieke consultatie bij stakeholders afgerond over de IVDR en de MDR, waarvan de resultaten momenteel worden verwerkt. En ook met het FAGG blijven we feedback verzamelen bij de betrokken stakeholders in België.