Monsieur Poels, la semaine dernière, nous avons conclu sur la charge administrative que représente l'IVDR pour les entreprises. Plus d'administration signifie également des coûts plus élevés pour ces entreprises. L’AFMPS le constate-t-il ?
La transition vers la nouvelle législation ne doit en effet pas être sous-estimée pour les entreprises du secteur des DIV. Pour les entreprises de dispositifs médicaux (MD), la réglementation a également changé avec l'arrivée du règlement sur les dispositifs médicaux (MDR), mais les modifications sont moins radicales que celles prévues par l'IVDR.
« Les entreprises du secteur des DIV sont souvent des PME qui ne disposent pas de moyens considérables. »
De plus, de nombreuses entreprises DIV sont des PME qui ne disposent pas des mêmes moyens que les fabricants MD, plus souvent de grande taille. L'Europe tente d'en tenir compte, par exemple avec le paquet de mesures en faveur des PME (2023) et une stratégie européenne spécifique pour les start-ups et les scale-ups (2025).
En reportant l'entrée en vigueur de l'IVDR et en prévoyant des périodes de transition supplémentaires, l'Europe souhaite donner à toutes les parties prenantes concernées suffisamment de temps pour se mettre en conformité.
La pression sur les entreprises du secteur des DIV reste toutefois réelle. Le renforcement des exigences en matière de preuves cliniques et les contrôles effectués par les organismes notifiés et, éventuellement, par les laboratoires de référence européens entraîneront inévitablement une augmentation des coûts pour les entreprises. Nous entendons donc que les fabricants de DIV évaluent de manière critique leur portefeuille de produits : quels produits souhaitent-ils « transférer » vers le cadre de l'IVDR et lesquels souhaitent-ils abandonner ?
Le renforcement de l'IVDR rend inévitablement l'innovation encore plus coûteuse qu'elle ne l'était déjà. Craignez-vous que l'IVDR freine l'innovation ?
C'est difficile à prédire aujourd'hui, mais j'espère que non. En tout état de cause, l'Europe ne veut pas en arriver là et a créé un groupe de travail chargé d'accélérer les procédures relatives aux « innovations de rupture ».
En tant qu'autorité très appréciée au sein de l'UE, l'AFMPS participe pleinement à cette initiative.
L'AFMPS est en effet une marque internationale forte en Europe. Cela ressort clairement du rôle très actif que vous jouez, entre autres, au sein du Medical Device Coordination Group (MDCG).
Notre administration est en effet très active, et ce dans les 13 groupes de travail du MDCG. Ces groupes de travail traitent tous les aspects pertinents pour la mise en œuvre de l'IVDR et du MDR, tels que la notification et le contrôle des organismes notifiés, la vigilance, le contrôle du marché, les études cliniques et de performance, etc.
« Les autorités compétentes d'autres États membres font régulièrement appel à l'expertise belge en matière de DIV. »
Un groupe de travail se concentre spécifiquement sur l'interprétation et la mise en œuvre homogènes des DIV , et conseille les 12 autres groupes sur des sujets spécifiques aux DIV. Depuis 2022, ce groupe DIV a publié pas moins de 16 documents d'orientation. En collaboration avec l'AFMPS, nous avons contribué à chacun de ces 16 documents, souvent en tant que chef de file. Les autorités compétentes des autres États membres de l'UE reconnaissent cette expertise et sollicitent régulièrement notre avis sur des sujets liés aux DIV.
J'ai d'ailleurs récemment été nommé coprésident du groupe de travail sur les DIV orphelins, qui sont des tests destinés à un très petit groupe de patients. Avec ce groupe de travail, nous examinons comment rendre les DIV orphelins plus facilement et plus rapidement disponibles en Europe.
Nous avons déjà longuement évoqué la pression supplémentaire que l'IVDR impose aux entreprises. Qu'en est-il de la pression sur votre administration ?
La base de données EUDAMED devrait à terme nous aider à alléger une partie de la charge administrative, mais ce n'est pas encore le cas aujourd'hui. Entre-temps, de nombreuses tâches ont été élargies et nous en avons reçu de nouvelles. Donc oui, l'IVDR entraîne également une pression supplémentaire pour nous, surtout à court terme.
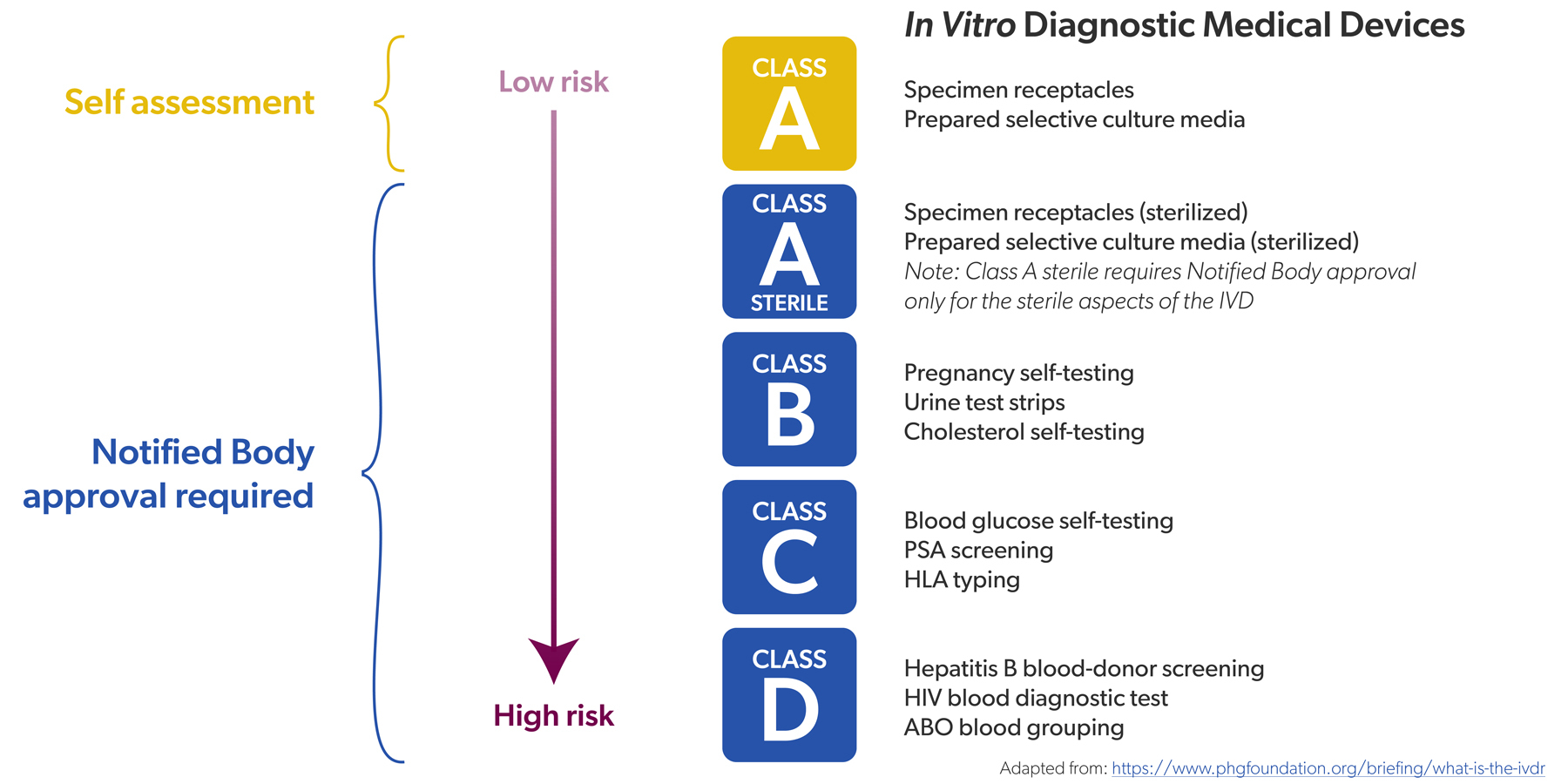
Dans le même temps, il y a des signes positifs importants. On a longtemps craint, à juste titre, que la capacité des organismes notifiés ne soit pas suffisante pour l'IVDR, le nombre de DIV devant faire l'objet d'une évaluation de conformité étant passé de 20 à 80 % (voir également la première partie de l'interview). Mais ce problème semble se résoudre.
Sur les 17 organismes notifiés pour l'IVDR, seuls deux ne prennent plus de nouveaux clients, selon une enquête récente. L'avant-dernier organisme notifié à figurer sur la liste est SGS Belgium. Notre pays dispose donc désormais d'un organisme notifié pour l'IVDR, ce qui est évidemment une bonne nouvelle pour les fabricants belges !

Nous constatons également une augmentation du nombre de demandes d'études de performance. Il s'agit souvent d'études combinées avec un médicament. Le test DIV sert alors à sélectionner les patients pour l'essai et peut être commercialisé ultérieurement comme diagnostic compagnon. Un grand projet européen, COMBINE, est actuellement en cours afin de simplifier et d'harmoniser les demandes d'études combinées.
Ces signaux sont très importants. Après tout, l'IVDR doit être une réussite.
Absolument, en premier lieu pour les patients et la santé publique.
Les avantages potentiels de l'IVDR pour les patients sont évidents :Plus les tests de diagnostic in vitro sont fiables et efficaces, plus ils bénéficient au patient . Et grâce à une meilleure traçabilité, les dispositifs posant problème peuvent être localisés de manière très précise.
« Plus les tests de diagnostic in vitro sont fiables et efficaces, plus ils bénéficient au patient»
Toutes les mesures prévues par l'IVDR y contribuent plus ou moins grandement. Il est inévitable qu'un changement réglementaire d'une telle ampleur soulève de nombreuses questions. Mais celles-ci ne doivent pas remettre en cause l'ensemble de la réforme.
Il est important d'évaluer l'IVDR de manière continue et rigoureuse et d'oser l'ajuster si nécessaire : que peut-on simplifier, quelles exigences offrent trop peu de valeur ajoutée et peuvent donc être modifiées ou supprimées, etc. L'Europe recherche activement ce retour d'information. Ainsi, une consultation publique des parties prenantes sur l'IVDR et le MDR s'est achevée fin mars et ses résultats sont actuellement en cours d'analyse. Nous continuons également à recueillir les commentaires des parties prenantes concernées en Belgique par l'intermédiaire de l'AFMPS.