Anouk Waeytens was jarenlang expert geneesmiddelen bij het Riziv, met een bijzondere focus op gepersonaliseerde therapieën. Sinds eind 2020 treedt ze op als adviseur voor (ontslagnemend) federaal minister van Sociale Zaken en Volksgezondheid Frank Vandenbroucke. Vanuit die rol was en is ze nauw betrokken bij de verschillende initiatieven rond companion diagnostics in ons land.
Mevrouw Waeytens, kunt u beknopt uitleggen wat companion diagnostics (CDx) precies zijn?
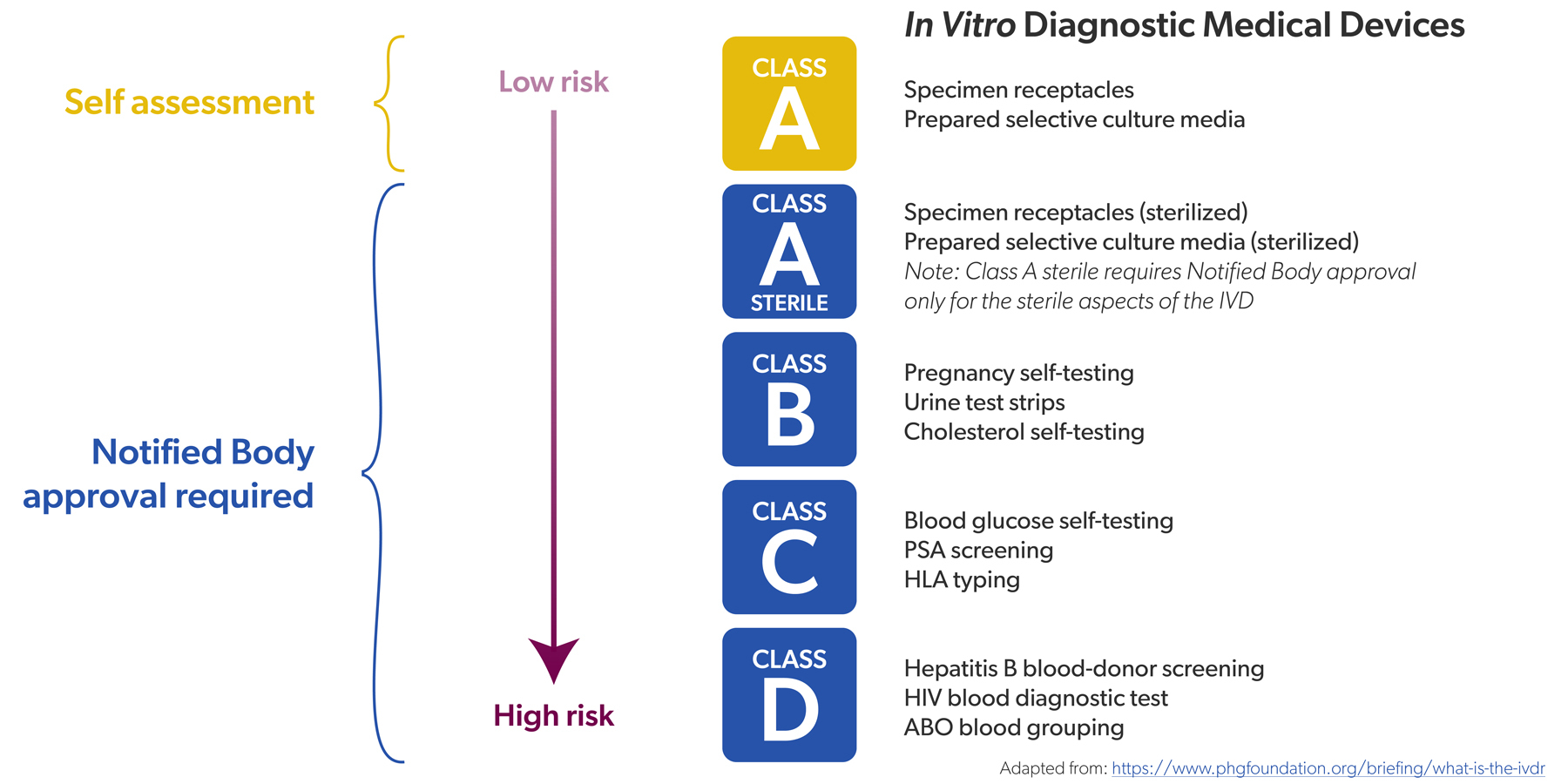
“CDx zijn medische tests die op voorhand helpen inschatten hoe goed een bepaald geneesmiddel zal werken bij een patiënt of hoe goed de patiënt dat geneesmiddel zal verdragen. Dat gebeurt aan de hand van een of meerdere biomerkers, kenmerken die voorspellen hoe effectief een bepaalde therapie wel of niet zal zijn. Als de test aantoont dat je over het juiste kenmerk beschikt, kan de arts de therapie opstarten. Indien niet, dan zoekt hij een alternatief.”
“Een voorbeeld is de biomerker BRAF V600. Dat is een gemuteerde variant van het BRAF-gen dat we allemaal hebben. De mutatie zorgt voor ongecontroleerde celdeling en ligt vaak aan de oorzaak van onder meer melanoma en longkanker. Er bestaan geneesmiddelen die die celdeling afremmen, maar die hebben enkel nut als de kanker veroorzaakt wordt door BRAF V600. Aan de hand van een CDx-test kunnen we op voorhand bij een patiënt bepalen of dat het geval is of niet.”
Wat is het grote voordeel daarvan?
“Het belangrijkste voordeel is de tijd die de patiënt wint. Met behulp van de test verklein je de kans om een behandeling op te starten die niet zal aanslaan bij de patiënt en die daarbovenop voorspelbare bijwerkingen heeft. Het is niet voor niets dat CDx tot nu toe vooral ontwikkeld worden voor aandoeningen waar precisie en tijdsdruk een grote rol spelen, zoals kanker.”
‘Met behulp van companion diagnostics verklein je de kans om een behandeling op te starten die niet zal aanslaan bij de patiënt of die voorspelbare bijwerkingen heeft’
“Ook voor de ziekteverzekering is dat positief: we geven minder belastinggeld uit aan therapieën die uiteindelijk niet werken bij een patiënt. De tests helpen met andere woorden om zo efficiënt mogelijk te investeren in de gezondheid van de patiënt.”
CDx worden vaak in één adem met kanker genoemd. Hoe zit het met andere aandoeningen?
“Dat is niet omdat kanker ‘belangrijker’ is dan andere aandoeningen. Wel door de hoge unmet medical need: voor veel kankers was of is er nog geen optimaal therapeutisch middel voorhanden. Als dat er wel al is, is de nood minder hoog om op zoek te gaan naar een targeted therapy. Wat ook meespeelt, is dat er lang meer geweten was over de ziektepathway bij kankers dan bij andere ziektes. Dat hielp om gepersonaliseerde behandelingen te ontwikkelen.”
“Intussen zie je steeds meer onderzoek naar gepersonaliseerde medicijnen voor hormonale aandoeningen, hart- en vaatziekten, neurodegeneratieve aandoeningen, immuunziektes, etc. ”
De terugbetalingsprocedures voor CDx-tests in België waren lang niet afgestemd op die voor gepersonaliseerde behandelingen. Gevolg: de voorspellende test dreigde pas later terugbetaald te worden dan de targeted therapy. Dat probleem hebben jullie proberen aan te pakken de voorbije legislatuur. Hoever staat het daarmee?
“We hebben de terugbetalingsprocedures voor targeted therapies en moleculaire companion diagnostics in juli 2019 gestroomlijnd, zodat die op hetzelfde moment terugbetaald worden. Waarom de focus op moleculaire merkers? Omdat de nood daar op dat moment het grootst was: er waren heel wat moleculaire merkers die heel traag of niet in de terugbetaling raakten.”
“In 2019 hebben we de terugbetaling van 29 werkzame stoffen – één stof kan voor meerdere indicaties terugbetaald worden – en hun moleculaire merkers gesynchroniseerd. Vandaag, 5 jaar later, zijn daar al 16 nieuwe werkzame stoffen bij gekomen. Dankzij die gekoppelde terugbetaling komen de therapie en de moleculaire merker nu steeds op hetzelfde moment in terugbetaling. Dat is een enorme verbetering tegenover vroeger.”
‘Vanaf 2026 kunnen geneesmiddelen in ons land terugbetaald worden van zodra ze een EMA-vergunning hebben. Dat geldt ook voor gepersonaliseerde geneesmiddelen en hun biomerkers’
“Veelbelovende behandelingen toegankelijker maken was en is een van de belangrijkste ambities van onze minister. Anders gezegd: we willen dat patiënten steeds toegang hebben tot de beste behandelingen, zeker in gevallen van medische nood. Dat verhaal is nooit af, maar we hebben de voorbije jaren grote stappen gezet.”
“Zo hebben we in mei 2024 de wettelijke basis kunnen leggen van een nieuwe procedure voor snelle terugbetaling. De uitvoeringsbesluiten en backoffice van deze procedure worden nu volop uitgewerkt, zodat geneesmiddelen vanaf 1 januari 2026 terugbetaald kunnen worden van zodra ze een vergunning van het European Medicines Agency hebben. Door de gekoppelde terugbetaling zal die snelle terugbetaling ook gebruikt kunnen worden voor gepersonaliseerde geneesmiddelen én hun biomerkers.”
‘Minder ruis dankzij artificiële intelligentie’
De enorme evolutie op het vlak van artificiële intelligentie (AI) kan en zal een enorme boost betekenen voor companion diagnostics, en ruimer, gepersonaliseerde zorg, meent Anouk Waeytens.
“AI kan enorm veel bijdragen in de R&D-fase van nieuwe tests. In de pathway van een aandoening zijn er zeer veel moleculen die een rol kunnen spelen. De juiste moleculen vinden, is een enorm werk. AI kan helpen om bepaalde panels te preselecteren en zo veel gerichter naar targets te zoeken. Anders gezegd: om de ruis aanzienlijk te verminderen.”
Ook bij de interpretatie van testresultaten ziet Anouk een rol weggelegd voor AI. “Met behulp van AI kan je heel veel gegevens samenbrengen: klinische data, gegevens over levensstijl, beeldvorming, anatomopathologische data… Dankzij de verbanden die we zo kunnen leggen, wordt het mogelijk om nog veel preciezer te bepalen welke behandeling voor welk type patiënt past.”
“Wordt dat eenvoudig? Uiteraard niet. Maar de overheid mag deze boot zeker niet missen.”
Samen met die gekoppelde terugbetaling zijn jullie in 2019 ook een proefproject gestart naar de terugbetaling voor moleculair-biologische tests met next-generation sequencing. Hoe belangrijk is dat voor gepersonaliseerde behandelingen?
“Bij sommige aandoeningen heb je één relevante biomerker, die je met een individuele test kan opsporen. Bij andere aandoeningen spelen verschillende merkers een rol. Je kan voor elk van die merkers een individuele diagnostische test afnemen. Of je kan ineens verschillende merkers onderzoeken via een panel: een next-generation sequencing- of NGS-test. Zo’n paneltest is om verschillende redenen interessant: je moet maar één test afnemen, je hoeft maar één staal af te nemen bij een patiënt, je wint tijd en het kan ook financieel voordeliger zijn dan wanneer je verschillende individuele tests moet afnemen.”
“In 2019 zijn we gestart met een pilootproject binnen hemato-oncologie om te kijken hoe we NGS zouden kunnen terugbetalen. Vandaag is deze vorm van testen standaard geworden en hebben we een volwaardige NGS-conventie uitgewerkt. Die hebben we flexibel opgevat, zodat nieuwe technologieën ook vlot in de terugbetaling geraken.”
Zowel over de individuele predictieve tests als over NGS-tests worden sinds het begin data verzameld via het PITTER-register. Welke rol speelt dat register?
“We hebben de terugbetaling van tests in 2019 gekoppeld aan de verplichte registratie van testresultaten door laboratoria in het publiek beschikbare PITTER-register. Dat gaat niet om specifieke genetische info over patiënten, wel om de generieke interpretatie ervan.”
“Op die manier verzamelen we epidemiologische gegevens over merkers voor heel België, en dat maakt het initiatief redelijk uniek in het Westen. Er bestaan vaak versnipperde, kleinschalige data: van klinische studies, universiteiten, etc. Maar nationale data heeft quasi niemand. Met ons register verzamelen we die nu wel in België, en daar zal iedereen de vruchten van plukken.”
‘Nationale epidemiologische gegevens over merkers heeft quasi geen enkel land. Met het PITTER-register verzamelen we die nu wel in België’
“We bekomen nationale benchmarks: stemmen de Belgische testresultaten overeen met wat internationaal gepubliceerd wordt? Op kleinere schaal kunnen onze laboratoria hun resultaten vergelijken met de Belgische benchmark: komen hun resultaten overeen met de nationale maatstaven of moeten ze hun testprocedures intern nakijken? Bedrijven krijgen een beter zicht op het aantal tests dat wordt gebruikt, hoeveel patiënten welke mutaties vertonen, etc. en kunnen daar dus beter op inspelen. En vanuit het beleid krijgen we een beter zicht op de echte meerwaarde van innovatieve behandelingen en kunnen we gericht bijsturen waar nodig.”
(lees verder onder de foto)

Waar moeten we de komende maanden en jaren verder op inzetten op het vlak van companion diagnostics?
“In 2019 zijn we begonnen met de gekoppelde terugbetaling van targeted therapies en tests naar moleculaire merkers, omdat de nood daar het hoogst was. Intussen blijven we kijken hoe we kunnen bijblijven met de evolutie, bijvoorbeeld de uitbreiding met predictieve tests naar andere merkers: immuunhistochemische merkers maar ook merkers die we via andere medische technologieën zoals medische beeldvorming opsporen.”
“Cruciaal met al die nieuwe technologieën wordt dat we de kwaliteit garanderen via de nodige standaardisatie, uniformisering, richtlijnen, etc. Een patiënt in Aarlen moet dezelfde mogelijkheden hebben als een patiënt in Oostende.”
‘De focus deze legislatuur lag op moleculaire merkers. Intussen kijken we hoe we kunnen bijblijven met de evolutie, bijvoorbeeld door de gekoppelde terugbetaling uit te breiden naar andere merkers’
“Vandaag scoren we met België bijvoorbeeld goed op het vlak van toegang tot gepersonaliseerde behandelingen, maar uit de evaluatie van het NGS-project blijkt ook dat niet alle patiënten de tests krijgen die ze volgens good clinical practice zouden moeten krijgen. Gepersonaliseerde zorg is met andere woorden niet louter een zaak van terugbetaling maar ook van de juiste omkadering en expertise bij zorgteams.”
Hoe zorgen we dat die omkadering mee evolueert?
“De sleutel ligt bij continu overleg met alle stakeholders. De Commissie Gepersonaliseerde Geneeskunde (ComPerMed) is daar een mooi voorbeeld van. Het is o zo belangrijk voor een overheid om te weten wat er echt leeft op het terrein. En omgekeerd is het voor het terrein nuttig om het bredere plaatje te zien waar beleidsmakers mee geconfronteerd worden. Wederzijds begrip leidt tot echte cocreatie en betere oplossingen.”